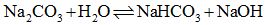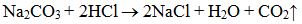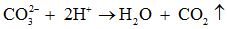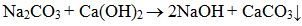Màu sắc của các chất hoá học
Kim loại kiềm và kiềm thổ
1. KMnO4: tinh thể màu đỏ tím.
2. K2MnO4: lục thẫm
3. NaCl: không màu, nhưng muối ăn có màu trắng là do có lẫn MgCl2 và CaCl2
4. Ca(OH)2: ít tan kết tủa trắng
5. CaC2O4 : trắng
Nhôm
6. Al2O3: màu trắng
7. AlCl3: dung dịch ko màu, tinh thể màu trắng, thường ngả màu vàng nhạt vì lẫn FeCl3
8. Al(OH)3: kết tủa trắng
9. Al2(SO4)3: màu trắng.
Sắt
10. Fe: màu trắng xám
11. FeS: màu đen
12. Fe(OH)2: kết tủa trắng xanh
13. Fe(OH)3: nâu đỏ, kết tủa nâu đỏ
14. FeCl2: dung dịch lục nhạt
15. Fe3O4(rắn): màu nâu đen
16. FeCl3: dung dịch vàng nâu
17. Fe2O3: đỏ
18. FeO : đen.
<19. FeSO4.7H2O: xanh lục.
20. Fe(SCN)3: đỏ máu
Đồng
21. Cu: màu đỏ
22. Cu(NO3)2: dung dịch xanh lam
23. CuCl2: tinh thể có màu nâu, dung dịch xanh lá cây
24. CuSO4: tinh thể khan màu trắng, tinh thể ngậm nước màu xanh lam, dung dịch xanh lam
25. Cu2O: đỏ gạch.
26. Cu(OH)2 kết tủa xanh lơ (xanh da trời)
27. CuO: màu đen
28. Phức của Cu2+: luôn màu xanh.<
Mangan
29. MnCl2 : dung dịch: xanh lục; tinh thể: đỏ nhạt.
30. MnO2 : kết tủa màu đen.
31. Mn(OH)4: nâu
Kẽm
32. ZnCl2 : bột trắng
33. Zn3P2: tinh thể nâu xám
34. ZnSO4: dung dịch không màu
Crom
35. Cr2O3 : đỏ sẫm.
36. CrCl2 : lục sẫm.
37. K2Cr2O7: đỏ da cam.
38. K2CrO4: vàng cam
Bạc
39. Ag3PO4: kết tủa vàng
40. AgCl: trắng.
41. Ag2CrO4: đỏ gạch
Các hợp chất khác
42. As2S3, As2S5 : vàng
43. Mg(OH)2 : kết tủa màu trắng
44. B12C3 (bo cacbua): màu đen.
45. Ga(OH)3, GaOOH: kết tủa nhày, màu trắng
46 .GaI3 : màu vàng
47. InI3: màu vàng
48. In(OH)3: kết tủa nhày, màu trắng.
49. Tl(OH)3, TlOOH: kết tủa nhày, màu hung đỏ
50. TlI3: màu đen
51. Tl2O: bột màu đen
52. TlOH: dạng tinh thể màu vàng
53. PbI2 : vàng tươi, tan nhiều trong nước nóng
54. Au2O3: nâu đen.
55. Hg2I2 ; vàng lục
56. Hg2CrO4 : đỏ
57. P2O5(rắn): màu trắng
58. NO(k): hóa nâu trong ko khí
59. NH3 làm quỳ tím ẩm hóa xanh
60. Kết tủa trinitrat toluen màu vàng.
61. Kết tủa trinitrat phenol màu trắng.
Màu của ngọn lửa
62. Muối của Li cháy với ngọn lửa màu đỏ tía
63. Muối Na ngọn lửa màu vàng
64. Muối K ngọn lửa màu tím
65. Muối Ba khi cháy có màu lục vàng
66. Muối Ca khi cháy có ngọn lửa màu cam
Các màu sắc của các muối kim loại khi cháy được ứng dụng làm pháo hoa
Màu của các nguyên tố
67. Li-màu trắng bạc
68. Na-màu trắng bạc
69. Mg-màu trắng bạc
70. K-có màu trắng bạc khi bề mặt sạch
71. Ca-màu xám bạc
72. B-Có hai dạng thù hình của bo; bo vô định hình là chất bột màu nâu, nhưng bo kim loại thì có màu đen
73. N-là một chất khí ở dạng phân tử không màu
74. O-khí không màu
75. F-khí màu vàng lục nhạt
76. Al-màu trắng bạc
77. Si-màu xám sẫm ánh xanh
78. P-tồn tại dưới ba dạng thù hình cơ bản có màu: trắng, đỏ và đen
79. S-vàng chanh
80. Cl-khí màu vàng lục nhạt
81. Iot (rắn): màu tím than
82. Cr-màu trắng bạc
83. Mn-kim loại màu trắng bạc
84. Fe-kim loại màu xám nhẹ ánh kim
85. Cu-kim loại có màu vàng ánh đỏ
86. Zn-kim loại màu xám nhạt ánh lam
87. Ba-kim loại trắng bạc
88. Hg-kim loại trắng bạc
89. Pb-kim loại trắng xám
Màu của ion trong dung dịch
90. Mn2+: vàng nhạt
91. Zn2+: trắng
92. Al3+: trắng
93. Cu2+ có màu xanh lam
94. Cu1+ có màu đỏ gạch
95. Fe3+ màu đỏ nâu
96. Fe2+ màu trắng xanh
97. Ni2+ lục nhạt
98. Cr3+ màu lục
99. Co2+ màu hồng
100. MnO4- màu tím
101. CrO4 2- màu vàng
Nhận dạng theo màu sắc
102. Đen: CuS ,FeS ,Fe2S3 ,Ag2S ,PbS ,HgS, CdS>
103. Hồng: MnS
104. Nâu: SnS
105. Trắng: ZnS, BaSO4, SrSO4, CaSO4, PbSO4, ZnS[NH2Hg]Cl
106. Vàng: CdS, BaCrO4, PbCrO4, (NH4)3[PMo12O40], (NH4)3[P(Mo2O7)4]
107. Vàng nhạt: AgI (ko tan trong NH3 đặc chỉ tan trong dd KCN và Na2S2O3 vì tạo phức tan Ag(CN)2- và Ag(S2O3)3)
Rất mong là bạn hàng tin cậy.